20/09/2021
Giá trị cuộc sống
STELLAPHARM sinh ra là để chăm sóc và bảo vệ sức khỏe cho người bệnh, giúp tăng cường đảm bảo chất lượng cuộc sống của mọi người. Sức khỏe của bạn, cho hôm nay và tương lai.
COVID-19 đã trở thành một đại dịch toàn cầu với hàng triệu ca tử vong. Một số vaccine an toàn và hiệu quả đã được phê duyệt giúp giảm sự lây nhiễm, giảm triệu chứng nặng hoặc tử vong. Mặc dù đã có hơn 5 tỷ liều vaccine đã được tiêm cho 33% dân số toàn cầu, chỉ có 1,4% dân số ở các nước thu nhập thấp nhận được ít nhất một liều vaccine. Hơn nữa, ở các quốc gia tiêm chủng với tỷ lệ cao nhất thế giới, biến chủng Delta của SARS-CoV-2 đã làm bùng phát COVID-19 trở lại. Tại Việt Nam, Tp. HCM và các tỉnh phía Nam đang chịu ảnh hưởng nặng nề của dịch bệnh. Vì vậy, nhu cầu về thuốc kháng virus là vô cùng cấp thiết trong giai đoạn hiện nay. Molnupiravir, remdesivir và các thuốc kháng thể đơn dòng sẽ được giới thiệu trong bài tổng quan này để xem xét quá trình nghiên cứu và phát triển, cơ chế kháng virus, tính an toàn và hiệu quả của thuốc.
1. GIỚI THIỆU
Theo báo cáo của Tổ chức Y tế Thế giới (WHO), tính đến ngày 13/9/2021, thế giới đã có hơn 225.551.978 triệu ca mắc COVID-19 với hơn 4.465.679 triệu ca tử vong (1). Cũng tính tới thời điểm này, Việt Nam hiện đã có 624.547 ca nhiễm với 15.660 ca tử vong (2). COVID-19 là bệnh truyền nhiễm gây ra bởi một loại betacoronavirus có tên SARS-CoV-2. Bệnh nhân mắc COVID-19 phần lớn (80%) có triệu chứng hô hấp nhẹ đến trung bình và hồi phục mà không cần đến những biện pháp điều trị đặc biệt. Trong đợt bùng phát đầu tiên, các triệu chứng đặc trưng của bệnh nhân nhiễm COVID-19 bao gồm sốt, ho, khó thở, mất khứu giác, mất vị giác… Với biến chủng Delta hiện nay, bệnh có những triệu chứng giống như cảm cúm thông thường như sốt nhẹ, ho, mệt mỏi, đau cơ. Một số trường hợp có đau họng, nghẹt mũi, chảy nước mũi, đau đầu, ho có đờm, đau bụng, buồn nôn, nôn và tiêu chảy. Những biểu hiện bệnh lý nặng như viêm phổi nặng, suy hô hấp, sốc nhiễm trùng, suy chức năng đa cơ quan và tử vong thường xảy ra ở những người cao tuổi, người có bệnh mạn tính hay suy giảm miễn dịch (2, 3).
Cấu tạo của virus SARS-CoV-2 bao gồm một lõi ARN, nang nucleocapsid, màng và phần vỏ với bề mặt có protein gai (protein S). Virus tấn công lên tế bào ký chủ bằng cách sử dụng protein S để gắn kết với thụ thể ACE2. Sau khi nhập bào, virus mở vỏ để phóng thích ARN và dịch mã thành các chuỗi polypeptid. Các đại phân tử này sau đó được enzymee 3-chymotrypsin like protase (3CLpro) và papain-like protease (PLpro) cắt thành những protein cấu trúc và không cấu trúc. Các protein không cấu trúc gồm những enzymee chức năng khác nhau, trong đó có enzymee ARN polymerase phụ thuộc ARN (RdRp). RdRp sẽ tổng hợp ARN cho virus, sau đó được đóng gói cùng với các thành cấu trúc khác trở thành hạt virus hoàn chỉnh và phóng thích ra ngoài để lây lan sang những tế bào mới (4).
Hiện nay, một số loại vaccine hiệu quả đã được chấp thuận để phòng ngừa COVID-19. Tuy nhiên, hiện nay sự tiếp cận với vaccine chậm hơn sự lây lan của dịch bệnh và vaccine cũng không đảm bảo hoàn toàn khả năng miễn nhiễm khỏi SARS-CoV-2. Thậm chí, tại các quốc gia có tỷ lệ tiêm vaccine cao nhất thế giới như Israel hay Ireland, số ca nhiễm vẫn tăng cao mỗi ngày. Do đó, nhu cầu về các thuốc kháng virus để điều trị và phòng ngừa COVID-19 vẫn rất cấp thiết. Trong tổng quan này, các thuốc kháng virus bao gồm phân tử nhỏ và kháng thể đơn dòng sẽ được giới thiệu về quá trình khám phá và phát triển, cơ chế tác dụng, các kết quả thử nghiệm lâm sàng và tình trạng phê duyệt.
2. THUỐC KHÁNG VIRUS PHÂN TỬ NHỎ
2.1. Molnupiravir
Molnupiravir là hợp chất kháng virus phổ rộng có mã số trong giai đoạn phát triển là EIDD-2801 và MK-4482. Từ năm 2013, hợp chất này được phát triển bởi Viện Phát triển thuốc Emory và công ty đổi mới sáng tạo mang tên Drug Innovation Ventures at Emory thuộc Đại học Emory (DRIVE), Georgia, Hoa Kỳ để điều trị Alphavirus (5). Khi đại dịch COVID-19 bắt đầu, molnupiravir được thử nghiệm tiền lâm sàng để điều trị cúm mùa trên mô hình động vật (6). Sau đó, dự án được mua lại bởi công ty Ridgeback Biotherapeutics và hiện công ty này đang hợp tác với hãng Merck & Co. để tiếp tục phát triển molnupiravir như một thuốc điều trị và phòng ngừa COVID-19 (7). Molnupiravir là tiền dược isopropylester của hợp chất nucleosid tổng hợp có tên NHC (Hình 1A), tức β-D-N4-hydroxycytidin (mã phát triển EIDD-1931). Cấu trúc 2 chiều và cấu trúc không gian của molnupiravir được minh họa ở Hình 1B. Molnupiravir là một chất tương tự ribonucleosid kháng virus bằng cách gây ra các lỗi sao chép trong quá trình phiên mã ARN (6, 8). Hiện nay, thuốc này đang trong giai đoạn thử nghiệm lâm sàng pha III trên bệnh nhân ngoại trú tại Hoa Kỳ. Tại Việt Nam, molnupiravir cũng đang được thử nghiệm lâm sàng cho điều trị bệnh nhân COVID-19 tại nhà từ ngày 27/8/2021. Nếu kết quả khả quan thì đây sẽ là thuốc giúp giảm được tỷ lệ chuyển nặng của bệnh nhân Covid và sẽ kéo giảm tỷ lệ tử vong xuống mức thấp.
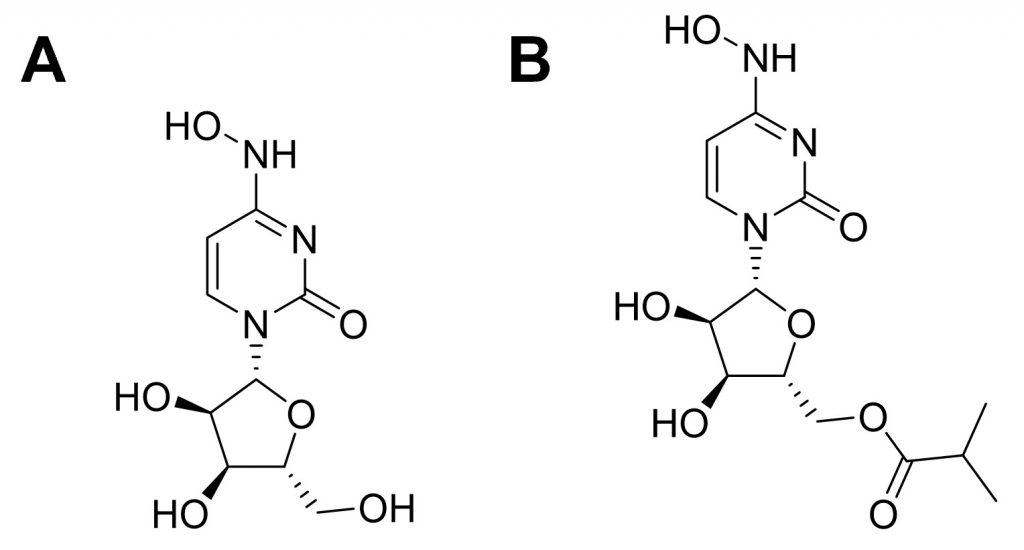
Hình 1. Cấu trúc hóa học của (A) β-D-N4-hydroxycytidin và (B) molnupiravir
EIDD-1931 được khám phá và phát triển từ năm 2013 để kháng một loại Alphavirus gây viêm não ở châu Mỹ có tên VEEV (Venezuelan equine encephalitis virus) lan truyền bởi loài muỗi Culex spp. Tác dụng của EIDD-1931 trên VEEV gợi ý rằng nó cũng có thể ức chế các virus ARN khác. Hợp chất này nhắm đến mục tiêu là enzymee ARN polymerase phụ thuộc ARN (RdRp) vốn có ở virus nhưng không có ở động vật có vú và do đó thuốc có tác dụng chọn lọc cao. Các enzyme này có tính bảo tồn cao nhất trong số các enzyme mã hóa của virus ARN, gợi ý hoạt phổ kháng virus rộng của hợp chất thử nghiệm. EIDD-1931 đã thể hiện hoạt tính kháng các virus ARN khác nhau như virus cúm mùa, coronavirus, virus hợp bào hô hấp, virus Chikungunya và virus Ebola. Sự chuyển hóa nhanh chóng của EIDD-1931 ở đường ruột dẫn đến sự ra đời của tiền dược EIDD-2801 – hiện được đặt tên là molnupiravir – với khả năng thấm qua niêm mạc ruột và hấp thu vào tuần hoàn hiệu quả hơn. Molnupiravir đã được đệ đơn xin thử nghiệm lâm sàng có tác dụng điều trị cúm mùa vào tháng 3 năm 2020. Khi đại dịch COVID-19 bùng phát dữ dội, đã có dữ liệu in vitro và in vivo chứng minh rằng EIDD-1931/2801 đã hoạt động chống lại SARS-CoV ở người và molnupiravir trở thành một liệu pháp tiềm năng cho việc dự phòng và điều trị COVID-19. Để bổ sung nguồn lực phát triển thuốc, DRIVE đã có một thỏa thuận hợp tác với công ty công nghệ sinh học Ridgeback Biotherapeutics và một đơn xin thử nghiệm lâm sàng thứ hai được đệ trình vào tháng 4 năm 2021 để điều trị COVID-19 (5).
NHC ức chế SARS-CoV-2 trong tế bào Vero E6 với IC50 = 0,30 mM và ở tế bào biểu mô phổi của người Calu-3 với IC50 = 0,08 mM mà không có độc tính tế bào đáng kể. NHC làm giảm sự sản xuất bộ gen ARN của virus được định lượng bằng phương pháp qRT-PCR với IC50 = 0,09 mM. NHC cũng có hiệu quả kháng các chủng virus đề kháng remdesivir và các coronavirus khác nhau lây truyền từ động vật (9). Chất chuyển hóa NHC 5’-triphosphat hoạt động như một cơ chất cạnh tranh thay thế trên enzyme RdRp của virus, dẫn đến sự kết hợp của hợp chất này vào ARN của virus và gây ra các đột biến dẫn đến một thảm họa lỗi (error catastrophe). Trong thử nghiệm điều trị nhiễm SARS-CoV-2 in vivo, sử dụng molnupiravir làm giảm số hạt virus lây nhiễm trong tế bào mô phổi người trên 25.000 lần sau 24 giờ và giảm 96% sau 48 giờ điều trị. Bên cạnh đó, việc sử dụng molnupiravir để dự phòng trước phơi nhiễm giúp giảm hiệu giá virus xuống hơn 100.000 lần (10).
Cơ chế kháng virus của molnupiravir đang được dần làm rõ. Thuốc làm tăng tần số đột biến ARN của SARS-CoV-2 và làm giảm sự nhân lên của virus trên mô hình động vật và ở người. Đầu tiên, RdRp sử dụng dạng hoạt động của molnupiravir là NHC triphosphat để làm chất nền thay cho cytidin triphosphat (CTP) hay uridin triphosphat (UTP) để tạo một sợi ARN lỗi. Khi RdRp tiếp tục sử dụng đoạn ARN lỗi này làm khuôn mẫu, NHC sẽ bắt cặp với A hoặc G và tạo ra các sản phẩm ARN đột biến. Giả thuyết này đã được chứng minh qua cấu trúc của phức hợp RdRp-ARN lỗi và sản phẩm ARN đột biến với sự hiện diện của NHC bắt cặp với adenin đã được chụp bằng kính hiển vi điện tử nghiệm lạnh và minh họa ở Hình 2 (11).
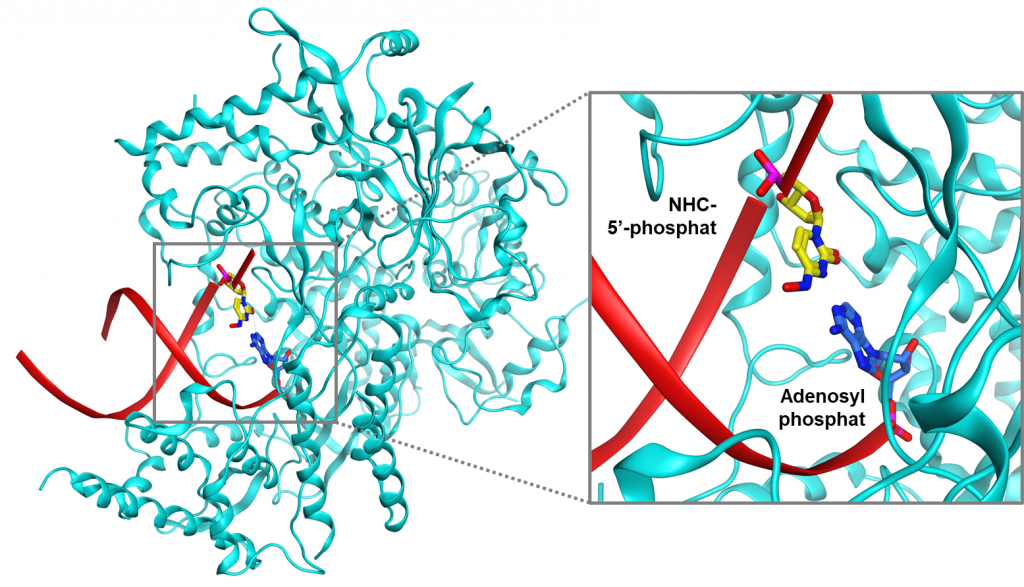
Hình 2. Cấu trúc của phức hợp RdRp (màu xanh lơ) và ARN đột biến (màu đỏ) với sự hiện diện của NHC (chất chuyển hóa có hoạt tính của molnupiravir, minh họa bởi cấu trúc chứa các nguyên tử carbon màu vàng) bắt cặp với adenin (minh họa bởi cấu trúc chứa các nguyên tử carbon màu xanh dương). Hình ảnh được tạo từ protein mã PDB: 7OZU.
Do những lo ngại về khả năng gây đột biến, khả năng gây độc gen của molnupiravir đã được đánh giá in vitro và in vivo. Trong đó, molnupiravir âm tính với thử nghiệm cảm ứng tổn thương nhiễm sắc thể in vitro và trên chuột. Trong thử nghiệm được thực hiện với liều lượng và thời gian lớn hơn đáng kể so với sử dụng trên lâm sàng, tác động của molnupiravir đối với tỷ lệ đột biến không khác biệt so với nhóm động vật đối chứng (5).
Trong thử nghiệm lâm sàng pha I (mã số ClinicalTrials.gov: NCT04392219), molnupiravir liều đơn và đa liều đã được đánh giá bằng nghiên cứu ngẫu nhiên, mù đơn, đối chứng với giả dược ở người tình nguyện khỏe mạnh. Chất chuyển hóa NHC xuất hiện nhanh chóng trong huyết tương với thời gian trung bình đạt nồng độ đỉnh là 1,00 đến 1,75 giờ. Nồng độ đỉnh (Cmax) và diện tích dưới đường cong nồng độ trong huyết tương so với thời gian (AUC) tăng tỷ lệ thuận với liều lượng và không có sự tích lũy sau khi dùng nhiều liều. Molnupiravir được dung nạp tốt và không có tác dụng phụ nghiêm trọng. Dưới 50% người thử nghiệm báo cáo một tác dụng phụ, tỷ lệ các tác dụng phụ cao hơn so với nhóm dùng giả dược, và 93,3% các tác dụng phụ là nhẹ. Một người tình nguyện đã ngừng thuốc sớm do phát ban. Không có phát hiện có ý nghĩa lâm sàng nào về xét nghiệm, dấu hiệu sinh tồn hoặc điện tâm đồ (12).
Trong thử nghiệm lâm sàng có mã số ClinicalTrials.gov NCT04746183 đối chứng ngẫu nhiên, nhãn mở được thực hiện tại Cơ sở Nghiên cứu Lâm sàng Hoàng gia Liverpool và Broadgreen (13). Người tham gia nghiên cứu là bệnh nhân người lớn được điều trị ngoại trú bị nhiễm SARS-CoV-2 (xác định bằng RT-PCR trong vòng 5 ngày kể từ khi khởi phát triệu chứng) được chia ngẫu nhiên theo tỷ lệ 2:1 trong 6 nhóm tham gia (3 nhóm sử dụng molnupiravir bằng đường uống 2 lần/ngày trong 5 ngày với liều lần lượt là 300, 600, 800 mg; và 3 nhóm đối chứng). Kết quả của nghiên cứu này được đăng trên Medrxiv.org (chưa qua bình duyệt) báo cáo molnupiravir an toàn và dung nạp tốt. Liều 800 mg ´ 2 lần/ngày trong 5 ngày được khuyến cáo để thử nghiệm lâm sàng phase II (14).
Thử nghiệm lâm sàng pha IIa với mã số NCT04405570 được thiết kế mù đôi, đối chứng với giả dược, ngẫu nhiên cho viên nang molnupiravir dùng bằng uống 2 lần/ngày ´ 5 ngày. Đây là thử nghiệm đa trung tâm được thực hiện tại Hoa Kỳ nhằm đánh giá tính an toàn, khả năng dung nạp và hiệu quả của molnupiravir trong việc loại trừ virus ở bệnh nhân COVID-19 (15). Trong báo cáo được đăng tải sớm trên Medrxiv.org, 202 bệnh nhân ngoại trú được xác nhận nhiễm SARS-CoV-2 và khởi phát triệu chứng trong vòng 7 ngày được chọn vào thử nghiệm. Người tham gia được chọn ngẫu nhiên với tỷ lệ 1:1 sử dụng molnupiravir 200 mg hoặc giả dược; tỷ lệ 3:1 sử dụng molnupiravir 400/800 mg hoặc giả dược, 2 lần/ngày ´ 5 ngày. Hoạt tính kháng virus được đánh giá là thời gian để đạt được mức độ ARN virus không thể phát hiện bằng RT-PCR và thời gian để loại trừ virus phân lập từ bệnh phẩm dịch tỵ hầu. Kết quả, virus phân lập ở nhóm sử dụng molnupiravir 800 mg thấp hơn đáng kể so với nhóm dùng giả dược ở ngày thứ 3 (1,9% so với 16,7%). Ở ngày thứ 5, virus không phân lập được từ các bệnh nhân dùng molnupiravir 400 và 800 mg so với nhóm dùng giả dược (11,1%) (16).
Một thử nghiệm lâm sàng pha II khác đang được thực hiện với mã số NCT04405739 để đánh giá tính an toàn và tác dụng của thuốc đối với sự phát tán của virus. Nghiên cứu được thiết kế ngẫu nhiên, mù đôi với molnupiravir dạng viên nén và giả dược (17). Bên cạnh đó, một thử nghiệm lâm sàng pha II/III được thiết kế ngẫu nhiên, đối chứng với giả dược, mù đôi để đánh giá hiệu quả, tính an toàn và dược động học của molnupiravir ở bệnh nhân người lớn mắc COVID-19 nhập viện (mã số NCT04575584) (18) và không nhập viện (mã số NCT04575597) (19). Tuy nhiên, Merck và Ridgeback Biotherapeutics đã thông báo sẽ dừng thử nghiệm lâm sàng phase III trên bệnh nhân nhập viện. Tại Việt Nam, ngày 14/08/2021, Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia đã xét duyệt đề cương và các tài liệu nghiên cứu “Thử nghiệm lâm sàng pha II/III, ngẫu nhiên, nhãn mở nhằm đánh giá tính an toàn và hiệu quả của viên nang molnupiravir kết hợp điều trị tiêu chuẩn so sánh với điều trị tiêu chuẩn đơn thuần ở bệnh nhân nhiễm COVID-19 được xác định bằng RT-PCR, mức độ nhẹ và vừa (nghiên cứu tại bệnh viện); kết hợp chương trình sử dụng thuốc có kiểm soát tại cộng đồng (nghiên cứu tại cộng đồng)” (20). Hiện nay một số bệnh viện trung ương, các trạm y tế cũng như các bệnh viện dã chiến và các trạm Y tế cơ sở đang theo dõi kết quả thử nghiệm với tổng số liều ban đầu dự kiến là hơn 100.000 liều (800 mg x 2 lần/ ngày x 5 ngày) từ nguồn thuốc nhập khẩu và các đơn vị sản xuất trong nước tài trợ.
2.2. Remdesivir
Remdesivir (GS-5734) là một thuốc kháng virus phổ rộng và là tiền dược của dẫn xuất adenosin nucleotid với cấu trúc được minh họa ở Hình 3A. Thuốc được phát triển bởi Gilead Sciences để điều trị bệnh do virus Ebola nhưng dự án bị dừng lại bởi sự xuất hiện của một kháng thể đơn dòng có tác dụng tốt hơn remdesivir trong thử nghiệm lâm sàng pha III (21).
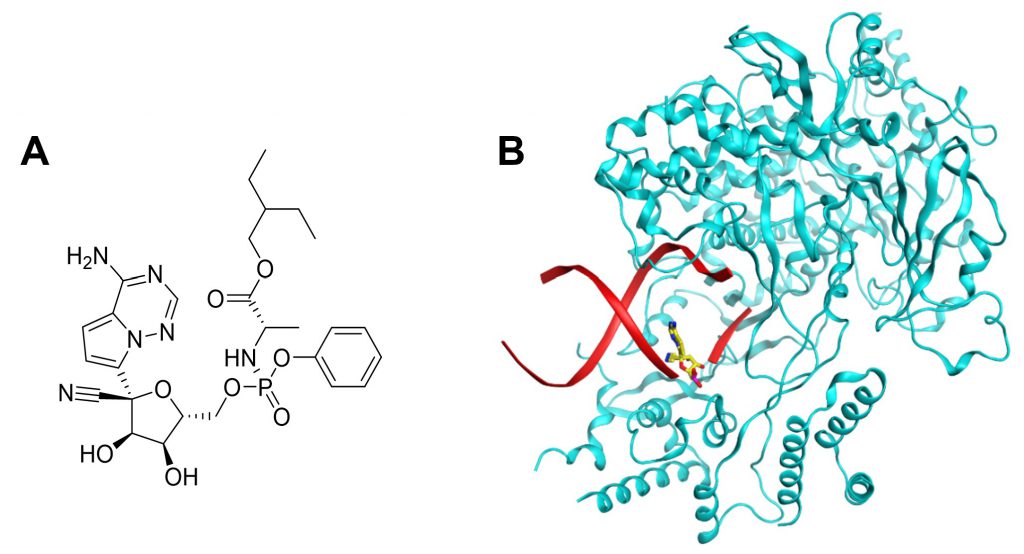
Hình 3. (A) Cấu trúc hóa học của remdesivir. (B) Phức hợp của RdRp (màu xanh lơ) với đoạn ARN (màu đỏ) có sự hiện diện của chất chuyển hóa remdesivir – một nucleotid triphosphat. Sau khi kết hợp remdesivir vào ARN, RdRp chỉ có thể tiếp tục bổ sung 3 nucleotid và quá trình sao chép bị dừng lại. Hình ảnh được tạo từ protein mã PDB: 7B3C.
Khi đại dịch COVID-19 bắt đầu, một thử nghiệm in vitro trên tế bào Vero E6 cho thấy remdesivir là chất kháng virus SARS-CoV-2 tiềm năng nhất với nồng độ hiệu quả 50% EC50 = 0,77 mM (22). Thử nghiệm lâm sàng pha III đối chứng ngẫu nhiên, mù bốn đã được thực hiện tại Trung Quốc từ tháng 2 đến tháng 3 năm 2020 (mã số NCT04257656) trên 237 bệnh nhân người lớn nhập viện vì mắc COVID-19 nặng. Kết quả cho thấy các bệnh nhân dùng remdesivir có thời gian cải thiện về lâm sàng nhanh hơn so với nhóm dùng giả dược mặc dù không có ý nghĩa thống kê (23). Một thử nghiệm lâm sàng đối chứng ngẫu nhiên, mù đôi, đa trung tâm khác được thực hiện tại Hoa Kỳ để đánh giá tính an toàn và hiệu quả remdesivir ở bệnh nhân người lớn nhập viện với COVID-19 (mã số NCT04280705). Kết quả thử nghiệm trên 1062 bệnh nhân từ tháng 2 đến tháng 4 năm 2020 lại cho thấy remdesivir vượt trội hơn so với giả dược trong việc rút ngắn thời gian hồi phục ở người lớn nhập viện với COVID-19 và có bằng chứng nhiễm trùng đường hô hấp dưới (24). Dựa trên kết quả này, remdesivir nhận được cấp phép khẩn cấp ở Hoa Kỳ vào ngày 01/05/2020 và sự chấp thuận có điều kiện tại Đài Loan để sử dụng cho bệnh nhân COVID-19 nặng. Từ tháng 6 đến tháng 8 năm 2020, remdesivir lần lượt nhận được sự chấp thuận có điều kiện tại các quốc gia khác như châu Âu, Canada, Singapore, Úc, Hàn Quốc, UAE và Ấn Độ. Ngày 10/08/2020, Gilead chính thức đệ đơn lên Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) Hoa Kỳ xin cấp phép thuốc mới cho remdesivir. Remdesivir được sử dụng ở dạng tiêm hoặc truyền tĩnh mạch với một liều đơn 200 mg/ngày vào ngày thứ nhất và 100 mg/ngày từ ngày thứ hai trở đi trong thời gian ít nhất là 5 ngày và không quá 10 ngày (25). Hiện nay, có tới 42 thử nghiệm lâm sàng đã được đăng ký tại ClinicalTrials.gov để tiếp tục đánh giá tính an toàn và hiệu quả của remdesivir trên các đối tượng bệnh nhân khác nhau, ở các quốc gia khác nhau, hoặc đánh giá hiệu quả khi sử dụng kết hợp với các thuốc khác. Vào nửa đầu năm 2020, Gilead đã ký kết các thỏa thuận cấp phép không độc quyền cho một số công ty tại các quốc gia thu nhập thấp hoặc trung bình như Ấn Độ, Ai Cập, Pakistan. Các giấy phép này sẽ miễn phí cho đến khi Tổ chức Y tế Thế giới công bố kết thúc tình trạng khẩn cấp y tế công cộng quốc tế liên quan đến COVID-19 hoặc cho đến khi một thuốc hoặc vaccine khác được chấp thuận để điều trị hoặc phòng ngừa COVID-19 (tùy theo điều kiện nào sớm hơn). Tại Việt Nam, Bộ Y tế đã có công văn số 6573/BYT-KCB ngày 12/8/2021 hướng dẫn tạm thời sử dụng remdesivir 100mg (5 mg/ml) theo hướng dẫn của FDA Hoa Kỳ và Cơ quan quản lý Dược phẩm châu Âu (EMA).
Remdesivir có cơ chế tác động trên quá trình sao chép ARN bởi enzyme RdRp của SARS-CoV-2. Tuy nhiên, khác với molnupiravir, remdesivir không gây đột biến mà làm dừng quá trình sao chép ARN bởi RdRp. Chất chuyển hóa của thuốc là một nucleotid triphosphat cạnh tranh với adenosin triphosphat và sẽ được RdRp kết hợp vào đoạn ARN đang được sao chép. Sự hiện diện của remdesivir trên đoạn ARN chỉ cho phép RdRp tiếp tục bổ sung thêm 3 nucleotid nữa trước khi quá trình sao chép bị dừng lại. Cấu trúc của phức hợp RdRp và ARN với sự hiện diện của remdesivir triphosphat đã được chụp bằng kính hiển vi nghiệm lạnh và minh họa ở Hình 3B (26).
3. KHÁNG THỂ ĐƠN DÒNG KHÁNG VIRUS
3.1. Casirivimab và imdevimab (REGEN-COV)
REGEN-COV (tên thương mại trước đây là REGN-COV2) là một chế phẩm phối hợp với tỷ lệ 1:1 của hai loại kháng thể đơn dòng casirivimab và imdevimab thuộc sở hữu của công ty Regeneron. Hai kháng thể này được phân lập từ các cá thể chuột được biến đổi gen để sinh ra các kháng thể người và từ huyết thanh của những người khỏi bệnh. Chúng đã được chứng minh có tác dụng ức chế protein gai (protein S) tại vùng gắn kết với thụ thể ACE2 ở người (receptor-binding domains – RBD) của virus SARS-CoV-2. Hai loại kháng thể đơn dòng này sẽ gắn kết tại các epitop không chồng lấp lên nhau, do đó sẽ có tác động hiệp lực trong điều trị COVID-19, bao gồm cả các biến thể B.1.617.2 (Delta), B.1.429 (Epsilon), hoặc P.1 (Gamma). Vị trí gắn kết của bộ đôi kháng thể trên RBD đã được chụp bằng kính hiển vi điện tử nghiệm lạnh và minh họa ở Hình 4 (27). Thử nghiệm lâm sàng pha III đối chứng ngẫu nhiên, mù đôi (mã số NCT04425629) cho thấy REGEN‑COV có hiệu quả giảm tỷ lệ nhập viện hoặc tử vong do COVID-19 với tỷ lệ 70% so với giả dược. Ngoài ra, thử nghiệm còn cho thấy ở nhóm có sử dụng REGEN-COV, có sự giảm tải lượng virus có ý nghĩa thống kê tại ngày 7, so với nhóm chứng (28). Ngày 21/11/2020, FDA Hoa Kỳ đã phê duyệt khẩn cấp REGEN-COV (casirivimab 600 mg và imdevimab 600 mg) cho chỉ định điều trị COVID-19 từ nhẹ đến trung bình cho người lớn và trẻ em (từ 12 tuổi trở lên và nặng ít nhất 40 kg). Ngoài ra, thuốc còn được chỉ định cho các đối tượng có nguy cơ tiến triển nặng, bao gồm cả các bệnh nhân trên 65 tuổi hoặc các bệnh nhân có kèm các bệnh lý mãn tính. REGEN-COV bị chống chỉ định ở các bệnh nhân đang điều trị COVID-19 bằng liệu pháp oxy hoặc phải nhập viện vì COVID-19 (29). Gần đây, REGEN-COV tiếp tục được FDA bổ sung chỉ định phòng ngừa COVID-19 sau khi tiếp xúc gần (sống cùng môi trường hoặc giao tiếp) với bệnh nhân đã được xác định mắc COVID‑19 dựa trên nghiên cứu COV-2069 (mã số NCT04452318). Chỉ định trên được đưa ra sau khi REGEN-COV đã chứng minh được khả năng giảm 81% số ca mắc bệnh sau khi tiếp xúc người bệnh, cũng như giảm khoảng thời gian có triệu chứng (1,2 tuần so với 3,2 tuần ở nhóm chứng) (30). Cũng lưu ý rằng chỉ định này không được phép dùng để thay thế các vaccine hiện có trong việc phòng ngừa COVID-19. Bộ đôi kháng thể đơn dòng này có thể được sử dụng dưới dạng tiêm truyền hoặc tiêm dưới da. Trong đó, tiêm truyền được ưu tiên hơn khi điều trị COVID-19, còn chỉ định phòng ngừa có thể sử dụng cả hai đường tiêm.
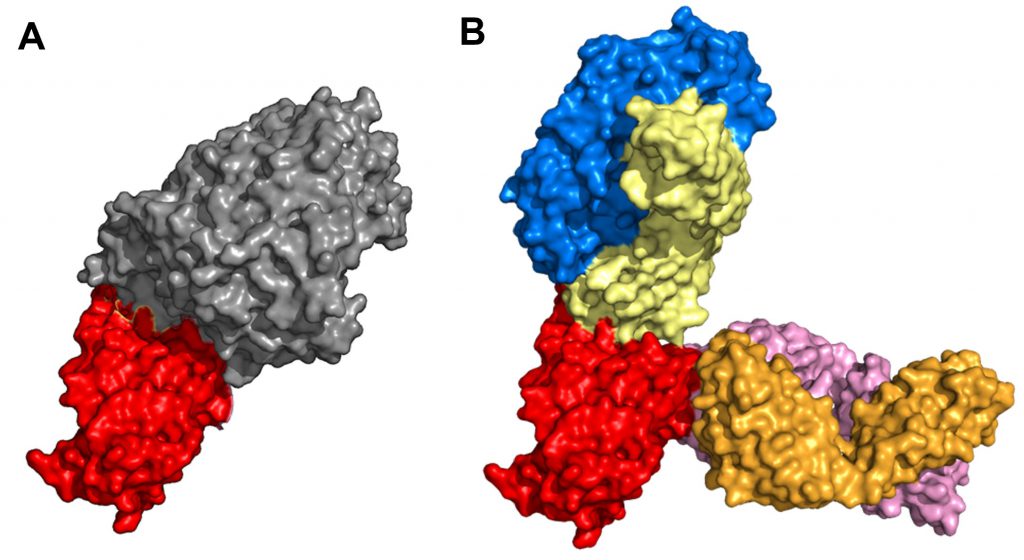
Hình 4. (A) Cấu trúc của RBD của SARS-CoV-2 (đỏ) gắn kết với thụ thể ACE2 (xám) (mã PDB: 6M0J). (B) Cấu trúc của RBD của SARS-CoV-2 (đỏ) bị ức chế bởi casirivimab (chuỗi nặng: màu xanh dương; chuỗi nhẹ: màu vàng) và imdevimab (chuỗi nặng: màu hồng; chuỗi nhẹ: màu cam) (mã PDB: 6XDG).
3.2. Bamlanivimab và etesevimab
Bộ đôi kháng thể đơn dòng được công ty Eli Lily phối hợp với Viện Hàn lâm khoa học Trung Hoa về Vi sinh học (IMCAS) phân lập từ huyết tương của các bệnh nhân đã khỏi bệnh (31). Phối hợp này đã chứng tỏ lợi ích lâm sàng ở người mắc COVID-19 từ nhẹ đến trung bình có nguy cơ tiến triển nặng hoặc nhập viện vì COVID-19, được thể hiện thông qua các thử nghiệm lâm sàng BLAZE-1 (mã số NCT04427501) và BLAZE-4 (mã số NCT04634409) và được FDA cấp phép khẩn cấp sử dụng cho các bệnh nhân điều trị ngoại trú từ 12 tuổi và nặng 40 kg trở lên từ tháng 2 năm 2021 (32). Tuy nhiên từ ngày 15/6/2021, phác đồ điều trị COVID-19 của Viện Y tế Quốc gia Hoa Kỳ (NIH) đã không còn khuyến cáo sử dụng phối hợp này do sự phát triển đề kháng của các biến chủng Gamma và Beta (33).
3.3. Sotrovimab
Sotrovimab (tên trong giai đoạn phát triển là VIR-7831) là một kháng thể đơn dòng được thu nhận và điều chỉnh từ huyết tương của người nhiễm SARS năm 2003 thuộc sở hữu của công ty GlaxoSmithKline (GSK). Sotrovimab là một kháng thể loại IgG1κ, gắn kết với RBD tại vị trí bảo tồn giữa SARS-CoV và SARS-CoV-2 với các biến đổi tại vùng hằng định (Fc) giúp tăng thời gian bán huỷ và tồn tại lâu hơn trong huyết tương người. Khác với các phối hợp kháng thể kể trên, các epitop của sotrovimab lại không cạnh tranh với ACE2 (34). FDA đã cấp phép khẩn cấp cho việc sử dụng sotrovimab cho bệnh nhân ngoại trú từ 12 tuổi và từ 40 kg cân nặng trở lên trong điều trị COVID-19 từ nhẹ đến trung bình, có nguy cơ tiến triển nặng vào ngày 26/5/2021 (35). Cơ sở của sự cấp phép này là dựa trên nghiên cứu lâm sàng pha III COMET-ICE (mã số NCT04545060). Nghiên cứu cho thấy ở các bệnh nhân sử dụng sotrovimab 500 mg tiêm truyền tĩnh mạch có sự giảm 85% tỷ lệ nhập viện hoặc tử vong do COVID-19. Kết quả này cho thấy lợi ích mà thuốc mang lại lớn hơn các nguy cơ hiện có (36).
4. KẾT LUẬN
Thuốc kháng virus SARS-CoV-2 vẫn là một nhu cầu cấp thiết trong phòng ngừa và điều trị COVID-19. Một số thuốc được giới thiệu ở trên đã có những kết quả thử nghiệm lâm sàng pha II, pha III khả quan và được cấp phép khẩn cấp. Các thử nghiệm lâm sàng vẫn đang được tiếp tục thực hiện để đánh giá hiệu quả và tính an toàn của các thuốc kháng virus nói trên. Bên cạnh vaccine, sự thành công của các thuốc kháng virus sẽ là một chìa khóa quan trọng để giảm diễn tiến nặng và tử vong của các bệnh nhân nhiễm COVID-19 cũng như góp phần kiểm soát đại dịch trong tương lai.
TÀI LIỆU THAM KHẢO
Nguồn: Đại học Quốc Gia Tp. Hồ Chí Minh (UHCM)
STELLAPHARM là một trong những công ty dược phẩm hàng đầu và là nhà sản xuất thuốc kháng virus tại Việt Nam. Công ty được thành lập vào năm 2000 tại Việt Nam; và chúng tôi chú trọng vào các thuốc kê đơn và thuốc không kê đơn đặc biệt trong điều trị các bệnh liên quan tim mạch, kháng virus, bệnh tiểu đường, v.v… và sản phẩm của công ty đang được sử dụng bởi hàng triệu bệnh nhân tại hơn 50 nước trên thế giới.
Công ty được chứng nhận toàn cầu về chất lượng thông qua việc các nhà máy sản xuất của công ty đã được thanh tra và phê duyệt bởi các cơ quan có thẩm quyền như cơ quan quản lý thuốc Châu Âu (EMA), cục Dược phẩm và thiết bị Y tế Nhật Bản (PMDA), cục quản lý Thực phẩm và Dược phẩm Đài Loan (Taiwan FDA), Tổ chức Y tế thế giới (WHO) và các tổ chức, cơ quan khác.
Để biết thêm thông tin về bài viết:
Công ty TNHH Liên Doanh Stellapharm – Chi nhánh 1 | 40 Đại lộ Tự Do, VSIP, P. An Phú, Thành phố Thuận An, Bình Dương
T: +84 274 376 7470 | F: +84 274 376 7469 | E: info@stellapharm.com | W: www.stellapharm.com
Sáng ngày 14/08/2021, tại Cục Khoa học công nghệ và Đào tạo, Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia đã tiến hành đánh giá, xét duyệt đề cương và các tài liệu nghiên cứu thử nghiệm lâm sàng “Thử nghiệm lâm sàng pha 2/3, ngẫu nhiên, nhãn mở nhằm đánh
Virus corona chủng mới – phát hiện lần đầu tiên tại thành phố Vũ Hán, Trung Quốc – được báo cáo đến Tổ chức Y tế Thế giới vào ngày 31/12/2019 và sau đó, căn bệnh liên quan đến loại virus này đã trở thành đại dịch toàn cầu. Kể từ đó đến nay,
Bệnh viện Phổi Trung ương đã triển khai nghiên cứu thử nghiệm lâm sàng thuốc kháng virus Molnupiravir theo phân công của Bộ Y tế, đến nay việc nghiên cứu đã bước đầu cho kết quả khả quan. Theo Giáo sư, Tiến sỹ Nguyễn Viết Nhung, Giám đốc Bệnh viện Phổi Trung ương, tỷ lệ