24/08/2021
Giá trị cuộc sống
STELLAPHARM sinh ra là để chăm sóc và bảo vệ sức khỏe cho người bệnh, giúp tăng cường đảm bảo chất lượng cuộc sống của mọi người. Sức khỏe của bạn, cho hôm nay và tương lai.
Virus corona chủng mới – phát hiện lần đầu tiên tại thành phố Vũ Hán, Trung Quốc – được báo cáo đến Tổ chức Y tế Thế giới vào ngày 31/12/2019 và sau đó, căn bệnh liên quan đến loại virus này đã trở thành đại dịch toàn cầu. Kể từ đó đến nay, giải pháp điều trị kháng virus hiệu quả luôn được nỗ lực tìm kiếm.
Virus corona sử dụng enzyme RNA polymerase phụ thuộc RNA (RNA-dependent RNA polymerase RdRp) để sao chép và phiên mã bộ gen RNA của chúng (chú thích: RdRp là enzyme đóng vai trò tối quan trọng trong quá trình nhân lên của virus). RdRp là mục tiêu quan trọng để phát triển các loại thuốc kháng virus chống lại virus corona. Cấu trúc của RdRp đã được báo cáo đối với virus SARS-CoV-1 và SARS-CoV-2, đồng thời cung cấp những hiểu biết sâu sắc về cơ chế tổng hợp RNA phụ thuộc vào RNA. Các cấu trúc này cũng cho phép các nghiên cứu cơ chế có thể hợp lý hóa các quá trình phân tử làm cơ sở cho tác động kháng virus của các hợp chất thuốc nhắm mục tiêu vào RdRp. [2]
Molnupiravir (còn được gọi là EIDD-2801 hay MK-4482) là tiền chất của chất tương tự ribonucleoside β-d-N4-hydroxycytidine (NHC hay EIDD-1931) có hoạt tính kháng virus và đã được chứng minh khả năng điều trị nhiều bệnh do nhiễm các loại virus RNA gây ra, bao gồm virus corona có khả năng gây bệnh cao, virus cúm và các chủng virus alpha gây bệnh não (như virus viêm não ngựa Miền Đông, Miền Tây và Venezuela) dựa trên các mô hình nghiên cứu phi lâm sàng. [1]
Molnupiravir là ‘ứng cử viên’ kháng virus đường uống hiện đang trong giai đoạn thử nghiệm lâm sàng giai đoạn III để điều trị cho bệnh nhân mắc COVID-19. Molnupiravir làm tăng tần suất đột biến RNA của virus và làm suy yếu sự nhân lên của SARS-CoV-2 trong các thử nghiệm ở động vật và người. [2]
Cơ chế phân tử gây đột biến SARS-CoV-2 do molnupiravir gây ra Molnupiravir nhanh chóng được phân cắt trong huyết tương thành EIDD-1931. Thành phần này sau đó phân bố vào các mô khác nhau và được chuyển hóa thành EIDD-1931-5′-triphosphat bởi các men kinase của vật chủ (Hình 1). EIDD-1931-5′-triphosphat chính là dạng có hoạt tính của molnupiravir. [1]
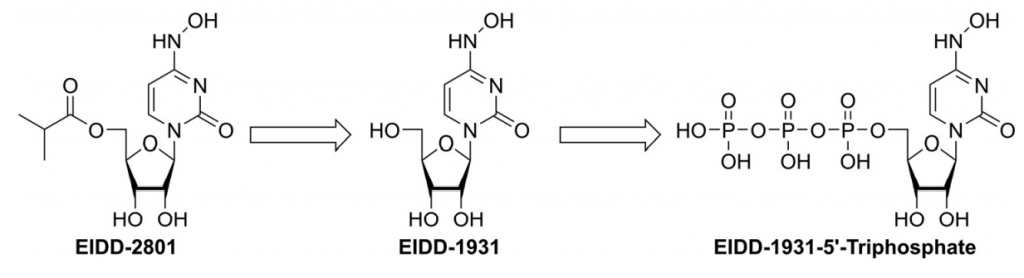
Hình 1. Molnupiravir được chuyển hóa nhanh chóng trong huyết tương thành EIDD-1931 (NHC). Sau khi phân bố vào các mô khác nhau, EIDD-1931 sẽ được chuyển đổi bởi kinase vật chủ và tạo thành EIDD-1931-5′-triphosphate, tác nhân có hoạt tính kháng virus. [1]
Các phân tích sinh hóa cho thấy RdRp (viral RNA-dependent RNA polymerase) – là enzyme polymerase phụ thuộc RNA của virus – sử dụng EIDD-1931-5′-triphosphat làm cơ chất thay vì cytidine triphosphate hoặc uridine triphosphate (chú thích: do chúng có cấu trúc tương tự nhau). Khi RdRp sử dụng RNA tạo thành làm khuôn mẫu cho quá trình sao chép, EIDD-1931-5′-triphosphate kết hợp với G hoặc A, dẫn đến việc hình thành các sản phẩm RNA đột biến (Hình 2). Dựa trên việc gắn vào chuỗi RNA mới được tổng hợp của virus, EIDD-1931-5′-triphosphat tạo ra hiệu quả kháng virus nhờ vào “thảm họa lỗi virus” (viral error catastrophe) – một khái niệm về việc tăng tỷ lệ đột biến của virus vượt quá ngưỡng có thể dung nạp được về mặt sinh học, vì thế dẫn đến việc virus bị suy yếu và sau đó bị tiêu diệt. Ngoài ra, phân tích cấu trúc của phức hợp RdRp–RNA có chứa các sản phẩm đột biến cho thấy EIDD-1931-5′-triphosphat có thể hình thành các cặp ba-zơ ổn định với G hoặc A trong vùng trung tâm hoạt động của RdRp, điều này giải thích cách mà polymerase tránh khỏi quá trình rà soát và sửa lỗi sao chép (proofreading) của virus, và từ đó tổng hợp RNA đột biến. [1], [2]
Cơ chế ‘gây đột biến hai bước’ này có thể áp dụng cho các polymerase của các virus khác nhau và có thể giải thích cho hoạt tính kháng virus phổ rộng của molnupiravir. [2]
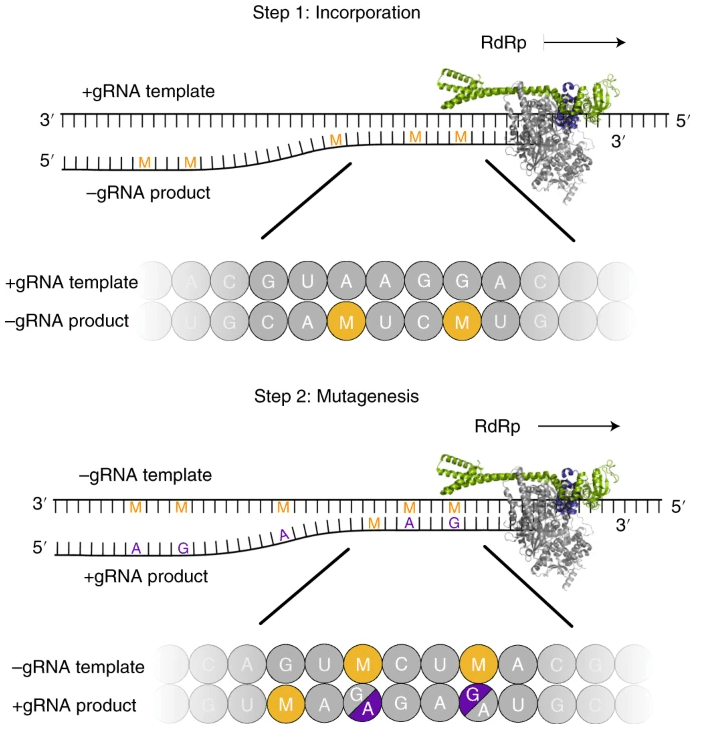
Hình 2. Mô hình hai bước (two-step model) của sự đột biến RNA do molnupiravir gây ra [2]
(EIDD-1931-5′-triphosphat (ký hiệu M) có thể được RdRp của SARS-CoV-2 sử dụng làm cơ chất thay vì cytidine triphosphate (ký hiệu C) hoặc uridine triphosphateor (ký hiệu U). Do đó, trong bước đầu tiên, RdRp được dự đoán sẽ thường xuyên kết hợp M thay vì C hoặc U khi nó sử dụng RNA sợi dương (+ gRNA: positive-strand genomic RNA) làm khuôn mẫu để tổng hợp RNA sợi âm (−gRNA: negative-strand genomic RNA; −sgRNA: negative-strand subgenomic RNA). Trong bước thứ hai, RNA thu được có chứa M có thể được sử dụng làm khuôn mẫu để tổng hợp +gRNA hoặc mRNA sợi dương (+sgmRNA: positive-strand subgenomic mRNA). Sự hiện diện của M trong −gRNA khiến các đột biến trong các sản phẩm RNA sợi dương được tạo ra, từ đó cản trở việc hình thành các virus mới một cách bình thường, dẫn đến ‘thảm họa lỗi’ – error catastrophe.)
Kết quả nghiên cứu về molnupiravir ở người cho đến nay
1. Dược động học
Molnupiravir theo chế độ đơn liều và đa liều đã được đánh giá trong nghiên cứu ngẫu nhiên, mù đôi, có đối chứng với giả dược (nghiên cứu giai đoạn I) trên người tình nguyện khoẻ mạnh, bao gồm cả đánh giá về ảnh hưởng của thức ăn đối với dược động học.
Molnupiravir được hấp thu tốt khi sử dụng đường uống và sự hấp thu bị ít ảnh hưởng bởi thức ăn. EIDD-1931 xuất hiện nhanh chóng trong huyết tương, thời gian trung bình đạt nồng độ tối đa (Tmax) là 1 – 1.75 giờ sau khi uống và thời gian bán thải (T1/2) vào khoảng 1 giờ, với giai đoạn đào thải chậm hơn sau khi dùng đa liều hoặc dùng liều đơn cao hơn (7.1 giờ ở liều cao nhất đã thử nghiệm). Nồng độ tối đa (Cmax) và diện tích phân bố dưới đường cong (AUC) thay đổi tỷ lệ thuận với liều uống và không có sự tích tụ sau khi dùng nhiều liều. Việc sử dụng thuốc cùng với thức ăn làm giảm tốc độ hấp thu nhưng không ảnh hưởng đến mức độ hấp thu. [1]
2. Khả năng dung nạp và độ an toàn
Theo kết quả nghiên cứu giai đoạn I, molnupiravir được dung nạp tốt ở liều 50 – 800 mg, 2 lần/ ngày trong 5,5 ngày và ở liều duy nhất lên đến 1,600 mg. Không ghi nhận tác dụng phụ nặng hoặc nghiêm trọng và không có khuynh hướng tăng tần suất hoặc mức độ nghiêm trọng của các tác dụng ngoại ý khi tăng liều molnupiravir. Ít hơn 50% số người tham gia thử nghiệm báo cáo gặp phải tác dụng phụ, tỷ lệ các tác dụng phụ cao hơn sau khi dùng giả dược, và 93.3% các tác dụng ngoại ý là nhẹ. Các tác dụng ngoại ý thường được báo cáo đều ở mức độ nhẹ (độ 1 – 2) bao gồm các triệu chứng giống cúm và triệu chứng hô hấp trên, nhức đầu, đau cơ, tiêu chảy và buồn nôn, đây cũng là những dấu hiệu phù hợp với trường hợp COVID-19 có triệu chứng. Không có những thay đổi đáng kể trong xét nghiệm lâm sàng, chỉ số huyết học, sinh hiệu hoặc điện tâm đồ. [1]
Các phân tích về tính an toàn của molnupiravir trong thử nghiệm giai đoạn II nhất quán với các phân tích từ thử nghiệm giai đoạn I và hỗ trợ cho các nghiên cứu lâm sàng đang diễn ra. Nhìn chung, molnupiravir được dung nạp tốt, không tăng các tác dụng phụ liên quan đến điều trị hoặc các tác dụng ngoại ý nghiêm trọng so với nhóm dùng giả dược. Không có những bằng chứng về độc tính đối với huyết học, thận hoặc gan tại bất kỳ liều lượng thử nghiệm nào. [3]
3. Hiệu quả lâm sàng
Kết quả của thử nghiệm đa trung tâm, ngẫu nhiên, mù đôi, đối chứng với giả dược (nghiên cứu pha IIa) – được thiết kế để đánh giá tính an toàn, khả năng dung nạp và hoạt tính kháng virus của molnupiravir sử dụng 2 lần/ngày trong 5 ngày để điều trị cho 202 bệnh nhân mắc COVID-19 mức độ nhẹ đến trung bình – cho thấy rằng molnupiravir có hiệu quả cao trong việc làm giảm virus SARS-CoV-2 ở vùng tỵ hầu và giảm lượng RNA virus, đồng thời cho thấy tính an toàn và khả năng dung nạp tốt. [3]
Ban đầu, phân lập được virus từ 43.5% mẫu bệnh phẩm tỵ hầu. Lượng virus phân lập thấp hơn đáng kể ở những người sử dụng 800mg molnupiravir (1.9%) so với giả dược (16.7%) ở ngày thứ 3 (p = 0,02). Ở ngày thứ 5, không có virus được phân lập từ bất kỳ người nào sử dụng 400 hoặc 800mg molnupiravir, so với 11.1% ở những người sử dụng giả dược (p = 0,03). Ở những người sử dụng 800mg molnupiravir, thời gian để đào thải RNA của virus đã giảm xuống và tỷ lệ đào thải lớn hơn so với giả dược (p = 0,01). Molnupiravir nhìn chung được dung nạp tốt, với mức độ các tác dụng ngoại ý tương tự trên tất cả các nhóm. [3]
Tại thời điểm bắt đầu thử nghiệm, chỉ có 2,8% số người tham gia có đáp ứng miễn dịch dịch thể. Tuy nhiên, đến ngày 28, 92.1% dương tính với kháng thể, chứng tỏ rằng việc điều trị sớm bằng molnupiravir có tác dụng kháng virus nhưng không ức chế sự phát triển của đáp ứng miễn dịch dịch thể. [3]
Các nghiên cứu đang diễn ra
Merck, hợp tác với Ridgeback Biotherapeutics, tiến hành thử nghiệm lâm sàng ngẫu nhiên, có đối chứng với giả dược (giai đoạn II/III) đối với molnupiravir ở những bệnh nhân mắc COVID-19 đã được xác nhận, không nhập viện, tại hơn 100 địa điểm trên toàn thế giới. [7]
Phần giai đoạn III của nghiên cứu toàn cầu MOVe-OUT (hay MK-4482-002) đang được thực hiện, nghiên cứu về tác dụng của molnupiravir ở bệnh nhân từ 18 tuổi trở lên mắc COVID-19 đã được xác nhận thông qua kết quả xét nghiệm và có ít nhất một dấu hiệu hoặc triệu chứng liên quan đến bệnh (như sốt, ho, hoặc mất vị giác hoặc khứu giác) (Hình 3). Ngoài ra, Merck có kế hoạch bắt đầu một chương trình lâm sàng để đánh giá hiệu quả của molnupiravir trong điều trị dự phòng sau phơi nhiễm vào nửa cuối năm 2021. [4], [5]

Hình 3. Nghiên cứu lâm sàng của Merck đối với COVID-19. [5]
Tăng cường khả năng tiếp cận molnupiravir trên toàn cầu
Theo ông Rob Davis – Chủ tịch tập đoàn dược phẩm Merck, ngoài thỏa thuận với chính phủ Hoa Kỳ về việc cung cấp 1.7 triệu liệu trình molnupiravir cho Hoa Kỳ, Merck còn tích cực tham gia vào nhiều nỗ lực để cung cấp molnupiravir trên toàn cầu nhằm thực hiện cam kết của Merck trong việc tăng cường khả năng tiếp cận rộng rãi của thế giới đối với thuốc này. Công ty có kế hoạch đệ trình xin sử dụng khẩn cấp hoặc xin phê duyệt ở các quốc gia khác ngoài Hoa Kỳ. Vào tháng 4 năm nay, Merck đã ký các thỏa thuận cấp phép tự nguyện (voluntary licensing agreement) với 5 nhà sản xuất thuốc generic của Ấn Độ để mở rộng khả năng tiếp cận với molnupiravir. Công ty cũng đã ký các thỏa thuận cấp phép tự nguyện không độc quyền với các nhà sản xuất thuốc generic khác để cung cấp thuốc ở 104 quốc gia có thu nhập thấp và trung bình. [6]
Hetero – một trong những nhà sản xuất thuốc generic kể trên – thông báo rằng họ đã thu thập được dữ liệu tích cực từ một nghiên cứu lâm sàng nhãn mở về molnupiravir và đã đệ trình những dữ liệu này lên Tổng cục kiểm soát dược phẩm của Ấn Độ (DCGI). Merck được khuyến khích bởi những dữ liệu đầy hứa hẹn này và mong muốn tiếp tục hợp tác với Hetero và các nhà sản xuất thuốc generic khác – những công ty mà Merck đã ký các thỏa thuận – khi họ tiến hành các nghiên cứu đối với phiên bản generic của thuốc thử nghiệm molnupiravir. [7]
Nguồn:
[1] Painter et al., Human safety, tolerability, and pharmacokinetics of Molnupiravir, a novel broad-spectrum oral antiviral agent with activity against SARS-CoV-2, Antimicrob Agents Chemother, Volume 65, Issue 5, May 2021.
[2] Florian Kabinger et al., Mechanism of molnupiravir-induced SARS-CoV-2 mutagenesis, Nature Structural & Molecular Biology, August 2021.
[3] William Fischer et al., Molnupiravir, an Oral Antiviral Treatment for COVID-19,MedRxiv, June 2021.
[4] Interim results from Phase 2/3 studies of molnupiravir, an investigational oral antiviral therapeutic for mild to moderate covid-19, presented at the European Congress of Clinical Microbiology & Infectious Diseases (ECCMID), Merck’s news release, July 2021.
[5] Merck’s COVID-19 Clinical Trial: https://merckcovidresearch.com
[6] https://www.pharmaceutical-business-review.com/news/merck-1-7-million-courses-molnupiravir-us/
[7] Merck Statement on Clinical Data for Molnupiravir Generated by Hetero in India, Merck’s news release, July 2021.
STELLAPHARM là một trong những công ty dược phẩm hàng đầu và là nhà sản xuất thuốc kháng virus tại Việt Nam. Công ty được thành lập vào năm 2000 tại Việt Nam; và chúng tôi chú trọng vào các thuốc kê đơn và thuốc không kê đơn đặc biệt trong điều trị các bệnh liên quan tim mạch, kháng virus, bệnh tiểu đường, v.v… và sản phẩm của công ty đang được sử dụng bởi hàng triệu bệnh nhân tại hơn 50 nước trên thế giới.
Công ty được chứng nhận toàn cầu về chất lượng thông qua việc các nhà máy sản xuất của công ty đã được thanh tra và phê duyệt bởi các cơ quan có thẩm quyền như cơ quan quản lý thuốc Châu Âu (EMA), cục Dược phẩm và thiết bị Y tế Nhật Bản (PMDA), cục quản lý Thực phẩm và Dược phẩm Đài Loan (Taiwan FDA), Tổ chức Y tế thế giới (WHO), các tổ chức và cơ quan khác.
Để biết thêm thông tin về bài viết:
Công ty TNHH Liên Doanh Stellapharm – Chi nhánh 1 | 40 Đại lộ Tự Do, VSIP, P. An Phú, Thành phố Thuận An, Bình Dương
T: +84 274 376 7470 | F: +84 274 376 7469 | E: info@stellapharm.com | W: www.stellapharm.com
[Cập nhật đến tháng 07/2021] Kết quả của thử nghiệm đã chứng minh tính an toàn, khả năng dung nạp và hiệu quả kháng virus của molnupiravir trong việc làm giảm sự sao chép của SARS-CoV-2, đẩy nhanh quá trình đào thải virus lây nhiễm, hỗ trợ các thử nghiệm đang được thực hiện của
Theo Tổ chức Y tế Thế giới, tỷ lệ béo phì toàn cầu đã tăng gấp 3 lần kể từ năm 1975. Mối liên hệ giữa béo phì và kháng insulin mang tính chất hai chiều. Tình trạng kháng insulin thường phát triển do nguyên nhân thừa cân hoặc béo phì và điều này có